Antybiotykoterapia w ropnym zapaleniu opon mózgowo-rdzeniowych
Autor: Lek. Monika Karlikowska-Skwarnik, dr hab. n. med. Ernest Kuchar
Ropne zapalenie opon mózgowo-rdzeniowych (ZOMR) jest w chorobach zakaźnych ostrym stanem bezpośrednio zagrażającym życiu. Ponadto może prowadzić do rozwoju trwałych powikłań zarówno w sferze zdrowia fizycznego, psychicznego, jak i funkcji poznawczych. Kluczowymi determinantami poprawy rokowania i ograniczenia trwałych następstw choroby jest szybkie rozpoznanie i rozpoczęcie właściwego leczenia antybiotykowego. Leczenia nie należy opóźniać celem wykonania badań diagnostycznych, w tym np. tomografii komputerowej, ponieważ wykazano, że wykonanie punkcji lędźwiowej u chorych bez objawów ogniskowych bez wcześniejszej tomografii komputerowej wiąże się wcześniejszym rozpoczęciem leczenia i lepszym rokowaniem.
Do możliwych czynników etiologicznych ZOMR – poza okresem noworodkowym – należą przede wszystkim bakterie otoczkowe, spośród których większości zakażeń potrafimy zapobiegać za pomocą szczepień ochronnych. Ze względu na ciężki przebieg i zwiększającą się oporność na powszechnie stosowane antybiotyki, istotna jest znajomość lokalnej epidemiologii oraz aktualnych rekomendacji leczenia empirycznego. Do elementów, które umożliwiają ustalenie optymalnego postępowania, w tym dobór najbardziej odpowiednie terapii, należą dane z wywiadu. Przed podjęciem decyzji o wyborze leczenia warto odpowiedzieć na kilka pytań dotyczących pacjenta:
• Jaki jest wiek dziecka?
• Czy mowa o zakażeniu szpitalnym czy nabytym w środowisku domowym?
• Czy dziecko ma wrodzoną wadę układu nerwowego, zastawkę komorowo-otrzewnową?
• Czy pacjent przebył uraz czaszkowo-mózgowy?
• Czy pacjent ma prawidłową odporność?
• Jakie szczepienia przeciwko bakteriom otoczkowym podano dziecku?
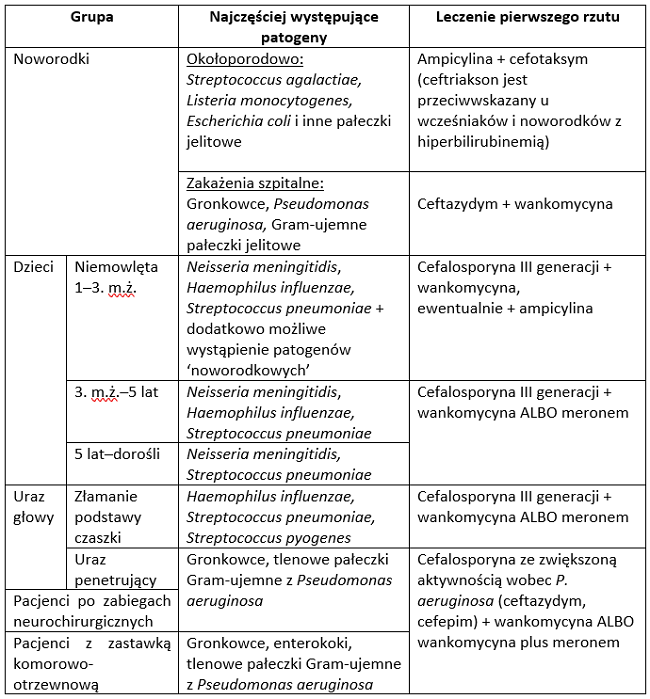
Wiek dziecka jest pierwszym czynnikiem determinującym dobór leczenia ze względu na istotne różnice pod względem czynników etiologicznych ZOMR w poszczególnych okresach życia. U noworodków dominujące patogeny to te, z którymi dziecko ma kontakt podczas porodu, a zatem Escherichia coli i inne Gram-ujemne pałeczki jelitowe, Streptococcus agalactiae, Listeria monocytogenes oraz Klebsiella. U niemowląt i małych dzieci należy w pierwszej kolejności brać pod uwagę zakażenia wywołane przez bakterie otoczkowe: meningokoki, Haemophilus influezae typu b, oraz pneumokoki Streptococcus pneumoniae. Grupę „przejściową” stanowią małe niemowlęta do 3. miesiąca życia, u których zdarzają się sporadycznie jeszcze zakażenia patogenami charakterystycznymi dla okresu noworodkowego. U dzieci powyżej 5 lat i młodzieży najczęściej izoluje się pneumokoki i meningokoki Neisseria meningitidis. U noworodków, zwłaszcza leczonych dłużej w oddziałach patologii noworodka lub intensywnej terapii, może dojść czasami do zakażeń szpitalnymi patogenami. W przypadku ZOMR najczęstsze czynniki związane z florą szpitalną to gronkowce złociste Staphylococcus aureus, Pseudomonas aeruginosa oraz Gram-ujemne pałeczki jelitowe. Dzieci po zabiegach neurochirurgicznych oraz posiadające zastawkę komorowo-otrzewnową to grupa ryzyka wystąpienia neuroinfekcji przez ciągłość, niejednokrotnie wywołanej przez gronkowce, w tym gronkowca złocistego i szczepy koagulazo-ujemne (np. Staphylococcus epidermidis), a także pałeczka ropy błękitnej Pseudomonas aeruginosa i inne tlenowe pałeczki Gram-ujemne oraz enterokoki. Odrębną grupę stanowią pacjenci urazowi – wśród chorych ze złamaniami podstawy czaszki dominują zakażenia pneumokokowe, Haemophilus influenzae typu b i Streptococcus pyogenes. W przypadku urazów penetrujących istnieje zagrożenie neuroinfekcji wywołanej przez gronkowce i tlenowe pałeczki Gram-ujemne wraz z pałeczką Pseudomonas aeruginosa.
Znajomość najczęstszych czynników etiologicznych ZOMR i ich lekowrażliwości zwiększa prawdopodobieństwo powodzenia antybiotykoterapii już na etapie leczenia empirycznego, a co za tym idzie – szybkie rozpoczęcie skutecznego leczenia. Podstawowe grupy antybiotyków stosowane w terapii neuroinfekcji to penicyliny, cefalosporyny III generacji, karbapenemy i glikopeptydy oraz aminoglikozydy. Spośród trzech najczęściej izolowanych u dzieci patogenów wywołujących neuroinfekcje: pneumokoków, meningokoków i Haemophilus influenzae typu b, najwięcej trudności terapeutycznych sprawić może leczenie zakażenia wywołanego przez Streptococcus pneumoniae. Według danych amerykańskich w ostatnich latach izoluje się oporne szczepy pneumokoków (na jeden i więcej antybiotyków) od ponad 30% chorych z inwazyjną chorobą pneumokokową [1]. Polskie dane są równie alarmujące. Według Krajowego Ośrodka Referencyjnego ds. Diagnostyki Bakteryjnych Zakażeń Ośrodkowego Układu Nerwowego (KOROUN) w roku 2018 odnotowano aż 25% izolatów pneumokoków wielolekoopornych (to jest niewrażliwych na co najmniej 3 klasy antybiotyków) u dzieci <2 lat z potwierdzoną inwazyjną chorobą pneumokokową. Dodatkowo w tej grupie wiekowej aż 21,4% izolatów było oporność na najczęściej używane cefalosporyny trzeciej generacji cefotaksym /ceftriakson, a 25% na penicylinę [2]. Ze względu na powyższe dane, empirycznym leczeniem z wyboru – „złotym standardem” w przypadku możliwej pneumokokowej etiologii zakażenia jest połączenie cefalosporyny III generacji z wankomycyną w celu objęcia działaniem przeciwbakteryjnym szczepów wielolekoopornych [3]. Ten zestaw antybiotyków jest najczęściej wybierany u niemowląt, dzieci i dorosłych, z uwagi na swoją skuteczność wobec Neisseria meningitidis i Haemophilus influenzae typu b. Alternatywę stanowi meronem w monoterapii. W grupie noworodków narażonych na zakażenie Listeria monocytogenes i Streptococcus agalactiae, schemat leczenia należy zmodyfikować, dodając ampicylinę (skuteczną wobec tych patogenów), którą podaje się łącznie z cefalosporyną III generacji lub aminoglikozydem (skutecznym wobec Gram-ujemnych pałeczek jelitowych i enterokoków). Chorzy z możliwym zakażeniem pałeczką ropy błękitnej Pseudomonas aeruginosa w pierwszej kolejności powinni otrzymać ceftazydym (cefalosporyna III generacji o zwiększonej aktywności przeciwko Pseudomonas) lub cefepim z grupy cefalosporyn IV generacji, zwykle w skojarzeniu z aminoglikozydem (gentamycyna). W przypadku zakażeń związanych z zabiegami neurochirurgicznymi leczeniem z wyboru jest zwykle podanie meronemu w skojarzeniu z wankomycyną. W przypadku dużego prawdopodobieństwa zakażenia gronkowcowego lekiem pierwszego rzutu w terapii empirycznej jest wankomycyna. Obecnie w każdym scenariuszu regułą jest stosowanie co najmniej dwóch antybiotyków. Monoterapia możliwa jest zwykle dopiero po uzyskaniu wyniku badania mikrobiologicznego i antybiogramu, potwierdzającego wrażliwość patogenu na podawany antybiotyk. Czas trwania terapii uzależniony jest od wyniku badania mikrobiologicznego i waha się od 7 dni w przypadku zakażeń meningokokowych do nawet 21 lub więcej w przypadku zakażeń Pseudomonas spp. lub pałeczkami Gram ujemnymi. U noworodków leczenie prowadzone jest przez 2 tygodnie po wyjałowieniu płynu mózgowo-rdzeniowego.
Tabela 1. Najczęstsze patogeny wywołujące ZOMR w poszczególnych grupach oraz podstawowy schemat leczenia (na podstawie [3]).
Podsumowując, skuteczna antybiotykoterapia zapalenia opon mózgowo-rdzeniowych uzależniona jest od znajomości lokalnej epidemiologii drobnoustrojów najczęściej wywołujących ZOMR w danej grupie wiekowej, ich lekooporności i stosowania antybiotyków zgodnie z lokalnymi rekomendacjami, podawanych we właściwych dawkach oraz przez odpowiednio długi czas. Niezwykle pomocne dla właściwego leczenia jest izolacja czynnika etiologicznego, co uzasadnia wszelkie wysiłki mające na celu uzyskanie materiału do badań mikrobiologicznych – płynu mózgowo-rdzeniowego oraz krwi. Warto pamiętać, że w przypadku trudności z pobraniem klasycznych posiewów, w ustaleniu bakterii odpowiedzialnej za neuroinfekcję pomocne jest przekazanie materiału pacjenta do KOROUN celem przeprowadzenia diagnostyki metodą PCR, która umożliwia wykrycie materiału genetycznego chorobotwórczych drobnoustrojów. Narodowy Program Ochrony Antybiotyków wdraża w życie szereg reguł mających na celu ograniczenie powstawania i rozpowszechniania szczepów wielolekoopornych poprzez racjonalną antybiotykoterapię oraz zwiększanie świadomości zarówno lekarzy, jak i pacjentów na temat „ochrony antybiotyków”, czyli racjonalnego gospodarowania tymi lekami ratującymi życie.
Lek. Monika Karlikowska-Skwarnik
Dr hab. n. med. Ernest Kuchar
Piśmiennictwo
1. Centers for Disease Control and Prevention. Antibiotic Resistance Threats in the United States, 2019 https://www.cdc.gov/DrugResistance/Biggest-Threats.html
2. Inwazyjna choroba pneumokokowa w Polsce w 2018 roku. Dane KOROUN. Warszawa, 2019; http://koroun.nil.gov.pl/wp-content/uploads/2019/07/Inwazyjna-choroba-pneumokokowa-IChP-w-Polsce-w-2018-roku-22.07.2019.pdf
3. Narodowy Program Ochrony Antybiotyków: Rekomendacje postępowania w zakażeniach bakteryjnych ośrodkowego układu nerwowego. Warszawa, 2011. http://antybiotyki.edu.pl/wp-content/uploads/Rekomendacje/rekomendacje-ukl-nerwowy_2011.pdf
4. The Sanford Guide to Antimicrobial Therapy 2019.
Do możliwych czynników etiologicznych ZOMR – poza okresem noworodkowym – należą przede wszystkim bakterie otoczkowe, spośród których większości zakażeń potrafimy zapobiegać za pomocą szczepień ochronnych. Ze względu na ciężki przebieg i zwiększającą się oporność na powszechnie stosowane antybiotyki, istotna jest znajomość lokalnej epidemiologii oraz aktualnych rekomendacji leczenia empirycznego. Do elementów, które umożliwiają ustalenie optymalnego postępowania, w tym dobór najbardziej odpowiednie terapii, należą dane z wywiadu. Przed podjęciem decyzji o wyborze leczenia warto odpowiedzieć na kilka pytań dotyczących pacjenta:
• Jaki jest wiek dziecka?
• Czy mowa o zakażeniu szpitalnym czy nabytym w środowisku domowym?
• Czy dziecko ma wrodzoną wadę układu nerwowego, zastawkę komorowo-otrzewnową?
• Czy pacjent przebył uraz czaszkowo-mózgowy?
• Czy pacjent ma prawidłową odporność?
• Jakie szczepienia przeciwko bakteriom otoczkowym podano dziecku?
Wiek dziecka jest pierwszym czynnikiem determinującym dobór leczenia ze względu na istotne różnice pod względem czynników etiologicznych ZOMR w poszczególnych okresach życia. U noworodków dominujące patogeny to te, z którymi dziecko ma kontakt podczas porodu, a zatem Escherichia coli i inne Gram-ujemne pałeczki jelitowe, Streptococcus agalactiae, Listeria monocytogenes oraz Klebsiella. U niemowląt i małych dzieci należy w pierwszej kolejności brać pod uwagę zakażenia wywołane przez bakterie otoczkowe: meningokoki, Haemophilus influezae typu b, oraz pneumokoki Streptococcus pneumoniae. Grupę „przejściową” stanowią małe niemowlęta do 3. miesiąca życia, u których zdarzają się sporadycznie jeszcze zakażenia patogenami charakterystycznymi dla okresu noworodkowego. U dzieci powyżej 5 lat i młodzieży najczęściej izoluje się pneumokoki i meningokoki Neisseria meningitidis. U noworodków, zwłaszcza leczonych dłużej w oddziałach patologii noworodka lub intensywnej terapii, może dojść czasami do zakażeń szpitalnymi patogenami. W przypadku ZOMR najczęstsze czynniki związane z florą szpitalną to gronkowce złociste Staphylococcus aureus, Pseudomonas aeruginosa oraz Gram-ujemne pałeczki jelitowe. Dzieci po zabiegach neurochirurgicznych oraz posiadające zastawkę komorowo-otrzewnową to grupa ryzyka wystąpienia neuroinfekcji przez ciągłość, niejednokrotnie wywołanej przez gronkowce, w tym gronkowca złocistego i szczepy koagulazo-ujemne (np. Staphylococcus epidermidis), a także pałeczka ropy błękitnej Pseudomonas aeruginosa i inne tlenowe pałeczki Gram-ujemne oraz enterokoki. Odrębną grupę stanowią pacjenci urazowi – wśród chorych ze złamaniami podstawy czaszki dominują zakażenia pneumokokowe, Haemophilus influenzae typu b i Streptococcus pyogenes. W przypadku urazów penetrujących istnieje zagrożenie neuroinfekcji wywołanej przez gronkowce i tlenowe pałeczki Gram-ujemne wraz z pałeczką Pseudomonas aeruginosa.
Znajomość najczęstszych czynników etiologicznych ZOMR i ich lekowrażliwości zwiększa prawdopodobieństwo powodzenia antybiotykoterapii już na etapie leczenia empirycznego, a co za tym idzie – szybkie rozpoczęcie skutecznego leczenia. Podstawowe grupy antybiotyków stosowane w terapii neuroinfekcji to penicyliny, cefalosporyny III generacji, karbapenemy i glikopeptydy oraz aminoglikozydy. Spośród trzech najczęściej izolowanych u dzieci patogenów wywołujących neuroinfekcje: pneumokoków, meningokoków i Haemophilus influenzae typu b, najwięcej trudności terapeutycznych sprawić może leczenie zakażenia wywołanego przez Streptococcus pneumoniae. Według danych amerykańskich w ostatnich latach izoluje się oporne szczepy pneumokoków (na jeden i więcej antybiotyków) od ponad 30% chorych z inwazyjną chorobą pneumokokową [1]. Polskie dane są równie alarmujące. Według Krajowego Ośrodka Referencyjnego ds. Diagnostyki Bakteryjnych Zakażeń Ośrodkowego Układu Nerwowego (KOROUN) w roku 2018 odnotowano aż 25% izolatów pneumokoków wielolekoopornych (to jest niewrażliwych na co najmniej 3 klasy antybiotyków) u dzieci <2 lat z potwierdzoną inwazyjną chorobą pneumokokową. Dodatkowo w tej grupie wiekowej aż 21,4% izolatów było oporność na najczęściej używane cefalosporyny trzeciej generacji cefotaksym /ceftriakson, a 25% na penicylinę [2]. Ze względu na powyższe dane, empirycznym leczeniem z wyboru – „złotym standardem” w przypadku możliwej pneumokokowej etiologii zakażenia jest połączenie cefalosporyny III generacji z wankomycyną w celu objęcia działaniem przeciwbakteryjnym szczepów wielolekoopornych [3]. Ten zestaw antybiotyków jest najczęściej wybierany u niemowląt, dzieci i dorosłych, z uwagi na swoją skuteczność wobec Neisseria meningitidis i Haemophilus influenzae typu b. Alternatywę stanowi meronem w monoterapii. W grupie noworodków narażonych na zakażenie Listeria monocytogenes i Streptococcus agalactiae, schemat leczenia należy zmodyfikować, dodając ampicylinę (skuteczną wobec tych patogenów), którą podaje się łącznie z cefalosporyną III generacji lub aminoglikozydem (skutecznym wobec Gram-ujemnych pałeczek jelitowych i enterokoków). Chorzy z możliwym zakażeniem pałeczką ropy błękitnej Pseudomonas aeruginosa w pierwszej kolejności powinni otrzymać ceftazydym (cefalosporyna III generacji o zwiększonej aktywności przeciwko Pseudomonas) lub cefepim z grupy cefalosporyn IV generacji, zwykle w skojarzeniu z aminoglikozydem (gentamycyna). W przypadku zakażeń związanych z zabiegami neurochirurgicznymi leczeniem z wyboru jest zwykle podanie meronemu w skojarzeniu z wankomycyną. W przypadku dużego prawdopodobieństwa zakażenia gronkowcowego lekiem pierwszego rzutu w terapii empirycznej jest wankomycyna. Obecnie w każdym scenariuszu regułą jest stosowanie co najmniej dwóch antybiotyków. Monoterapia możliwa jest zwykle dopiero po uzyskaniu wyniku badania mikrobiologicznego i antybiogramu, potwierdzającego wrażliwość patogenu na podawany antybiotyk. Czas trwania terapii uzależniony jest od wyniku badania mikrobiologicznego i waha się od 7 dni w przypadku zakażeń meningokokowych do nawet 21 lub więcej w przypadku zakażeń Pseudomonas spp. lub pałeczkami Gram ujemnymi. U noworodków leczenie prowadzone jest przez 2 tygodnie po wyjałowieniu płynu mózgowo-rdzeniowego.
Tabela 1. Najczęstsze patogeny wywołujące ZOMR w poszczególnych grupach oraz podstawowy schemat leczenia (na podstawie [3]).

Podsumowując, skuteczna antybiotykoterapia zapalenia opon mózgowo-rdzeniowych uzależniona jest od znajomości lokalnej epidemiologii drobnoustrojów najczęściej wywołujących ZOMR w danej grupie wiekowej, ich lekooporności i stosowania antybiotyków zgodnie z lokalnymi rekomendacjami, podawanych we właściwych dawkach oraz przez odpowiednio długi czas. Niezwykle pomocne dla właściwego leczenia jest izolacja czynnika etiologicznego, co uzasadnia wszelkie wysiłki mające na celu uzyskanie materiału do badań mikrobiologicznych – płynu mózgowo-rdzeniowego oraz krwi. Warto pamiętać, że w przypadku trudności z pobraniem klasycznych posiewów, w ustaleniu bakterii odpowiedzialnej za neuroinfekcję pomocne jest przekazanie materiału pacjenta do KOROUN celem przeprowadzenia diagnostyki metodą PCR, która umożliwia wykrycie materiału genetycznego chorobotwórczych drobnoustrojów. Narodowy Program Ochrony Antybiotyków wdraża w życie szereg reguł mających na celu ograniczenie powstawania i rozpowszechniania szczepów wielolekoopornych poprzez racjonalną antybiotykoterapię oraz zwiększanie świadomości zarówno lekarzy, jak i pacjentów na temat „ochrony antybiotyków”, czyli racjonalnego gospodarowania tymi lekami ratującymi życie.
Lek. Monika Karlikowska-Skwarnik
Dr hab. n. med. Ernest Kuchar
Piśmiennictwo
1. Centers for Disease Control and Prevention. Antibiotic Resistance Threats in the United States, 2019 https://www.cdc.gov/DrugResistance/Biggest-Threats.html
2. Inwazyjna choroba pneumokokowa w Polsce w 2018 roku. Dane KOROUN. Warszawa, 2019; http://koroun.nil.gov.pl/wp-content/uploads/2019/07/Inwazyjna-choroba-pneumokokowa-IChP-w-Polsce-w-2018-roku-22.07.2019.pdf
3. Narodowy Program Ochrony Antybiotyków: Rekomendacje postępowania w zakażeniach bakteryjnych ośrodkowego układu nerwowego. Warszawa, 2011. http://antybiotyki.edu.pl/wp-content/uploads/Rekomendacje/rekomendacje-ukl-nerwowy_2011.pdf
4. The Sanford Guide to Antimicrobial Therapy 2019.