4 Borelioza z Lyme u dzieci – postępowanie i racjonalna antybiotykoterapia
Autor: Lek. Karolina Sidorowska
Borelioza to choroba odzwierzęca, wywołana przez krętki z rodzaju Borrelia. Zwierzęta leśne i niektóre gatunki ptaków są głównym rezerwuarem bakterii. Za przenoszenie krętków odpowiadają kleszcze z rodzaju Ixodes. W rejonach endemicznych odsetek zakażonych kleszczy sięga nawet 25–30% populacji [1].
W ostatnim czasie zaobserwowano gwałtowny wzrost zachorowań na choroby przenoszone przez kleszcze (ang. tick-borne diseases, TBD). Przyczyną są zmiany klimatyczne związane z ogólnym ociepleniem, krótkie zimy, wilgotne i długie lata, rozwój turystyki oraz zamiany stylu życia związane z aktywnymi formami wypoczynku wśród przyrody i roślinności [2].
Kleszcze, żywiąc się krwią zwierząt, ulegają zakażeniu bakteriami. Krętki rozwijają się w jelicie cienkim kleszcza, przenikają do krwi, a następnie w ostateczności do jego gruczołów ślinowych. Człowiek może ulec zakażeniu w trakcie ukąszenia przez kleszcza. Do transmisji może także dojść poprzez wtarcie w zranione miejsce na skórze rozgniecionego owada lub jego treści, kału. Czas,
w którym dochodzi do zakażenia, to maksymalnie 48 godzin od narażenia [3]. Wraz z czasem żerowania kleszcza na skórze ryzyko infekcji rośnie. Jeżeli przebywa on krócej niż jedną dobę, prawdopodobieństwo zakażenia jest niewielkie, ale po 72 godzinach rośnie nawet do 100% [1, 4].
Wiele różnych gatunków wchodzi w skład kompleksu Borrelia burgdorferii sensu lato. W zakażeniach u ludzi dominują trzy. Są to: Borrelia burgdorferii sensu stricto, Borrelia garinii i Borrelia afzelii [5, 6].
Borrelia burgdoferii wykazuje powinowactwo do trzech układów: tkanki łącznej, tkani mięśniowej
i tkanki nerwowej. Choroba może zająć skórę, układ mięśniowo-szkieletowy, oczy, serce, ośrodkowy i obwodowy układ nerwowy. To doprowadza do różnorodnych objawów klinicznych. Borelioza zazwyczaj przebiega w 3 stadiach:
1. Wczesna miejscowa – zwykle występuje rumień wędrujący, rzadziej rzekomy chłoniak limfocytowy skóry. Czasami to stadium mija niezauważone, a choroba ujawnia się dopiero w fazie rozsianej;
2. Wczesnia rozsiana – zajęcie układu nerwowego (neuroborelioza), rzadziej zajęcie mięśnia sercowego, zapalenie stawów;
3. Późna przewlekła – powyżej jednego roku od zakażenia, rzadko występuje u dzieci, dochodzi do trwałego uszkodzenia układu nerwowego, oka, układu ruchu [7–9].
Rumień wędrujący przypomina plamkę lub grudkę z centralnym przejaśnieniem i może osiągać różne rozmiary. U dzieci najczęściej występuje na skórze głowy i szyi [10]. W niektórych przypadkach dochodzi do powstania wczesnej rozsianej skórnej postaci boreliozy, zwanej rumieniem wędrującym mnogim. Przyczyną jest rozsiew krętków za pomocą krwi lub chłonki do dalej położonych obszarów skóry [11]. Należy pamiętać, że brak rumienia wędrującego
w wywiadzie nie wyklucza rozpoznania boreliozy [12].
Neuroborelioza to zmiany patologiczne, którym towarzyszą objawy pochodzące z różnych struktur centralnego i obwodowego układu nerwowego. Choroba może manifestować się bólami głowy, sztywnością karku oraz łagodną enceflopatią. Ostre objawy mogą ustąpić samoistnie bez leczenia [13].
Postać sercowa u dzieci występuje bardzo rzadko, zaś w populacji ogólnej u około 5% chorych. Obecnie rzadko dochodzi do zapalenia serca, ponieważ choroba jest szybciej rozpoznawana i skuteczniej leczona. Postać ta może manifestować się jako zapalenie mięśnia sercowego i/lub osierdzia/wsierdzia, zaburzenia przewodnictwa, migotanie przedsionków lub częstoskurcz. Następstwem zapalenia serca może być kardiomiopatia [14].
Przebieg kliniczny zmian dotyczących układu mięśniowo-stawowego ma charakter nawracający
z ostrymi napadami zapalenia i remisji. Choroba najczęściej zajmuje stawy: kolanowe, skokowe, biodrowe, łokciowe, nadgarstkowe, rzadziej drobne stawy rąk, stóp czy stawy skroniowo-żuchwowe.
Borelioza może również dawać niespecyficzne objawy ogólne oraz problemy diagnostyki laboratoryjnej. Do nieswoistych objawów ogólnych zalicza się: osłabienie, napadowe bóle karku, upośledzenie termoregulacji, zaburzenia narządu słuchu i wzroku, zaburzenia poznawcze [15]. Podczas zachorowania bardzo często nie występują wszystkie objawy. Większość dzieci jest diagnozowana w stadium wczesnym ograniczonym (głównie występuje rumień wędrujący) lub wczesnym rozsianym (najczęściej rozpoznawane jest zapalenie opon mózgowo-rdzeniowych i/lub porażenie nerwu twarzowego). Niektóre objawy poszczególnych stadiów choroby występują razem.
Jeżeli u dzieci nie zastosowano antybiotykoterapii, objawy ustępują samoistnie do 12 tygodni. Należy jednak pamiętać, że do kilku miesięcy od zakażenia mogą pojawić się objawy wskazujące na stadium wczesne rozsiane. Dalszy przebieg choroby manifestuje się zmiennością nasilenia objawów i wielokrotnymi nawrotami. Jeśli chory nie będzie leczony, występuje ryzyko utrzymywania się dolegliwości przez kilka lat. Może również dojść do rozwoju przewlekłych objawów późnego stadium [16, 17].
Rozpoznanie boreliozy na podstawie obrazu klinicznego bywa trudne. W wielu przypadkach nie stwierdza się rumienia wędrującego, brak w wywiadzie informacji o ukąszeniu kleszcza, a jednoczasowe występowanie wszystkich możliwych objawów boreliozy zdarza się bardzo rzadko. W tych sytuacjach potrzebna jest diagnostyka laboratoryjna. Nie ma jednoznacznego testu diagnostycznego dla boreliozy, ponieważ antygen bakterii jest zmienny i ma złożoną budowę. Mimo to w wielu przypadkach dostępne metody pozwalają na potwierdzenie rozpoznania
i zastosowanie skutecznej terapii. Wśród badań diagnostycznych należy wymienić detekcje przeciwciał IgG i IgM metodami ELISA/Western blot. Dodatkowo zastosowanie mają diagnostyka biologii molekularnej (PCR, badanie histopatologiczne wycinka skóry, badanie płynu mózgowo-rdzeniowego, badanie płynu stawowego) [12].
Podstawą leczenia boreliozy jest antybiotykoterapia. Decyzję o rozpoczęciu leczenia należy podjąć wtedy, gdy pacjent prezentuje objawy kliniczne. Błędem jest zastosowanie antybiotyku tylko na podstawie dodatniego badania serologicznego bez manifestacji objawów klinicznych [18]. Poniżej w tabeli przedstawiono zasady leczenia boreliozy u dzieci i młodzieży według aktualnych wytycznych NICE z 2018 r.
Tabela 1. Zasady leczenia boreliozy u dzieci i młodzieży według wytycznych NICE z 2018 r.
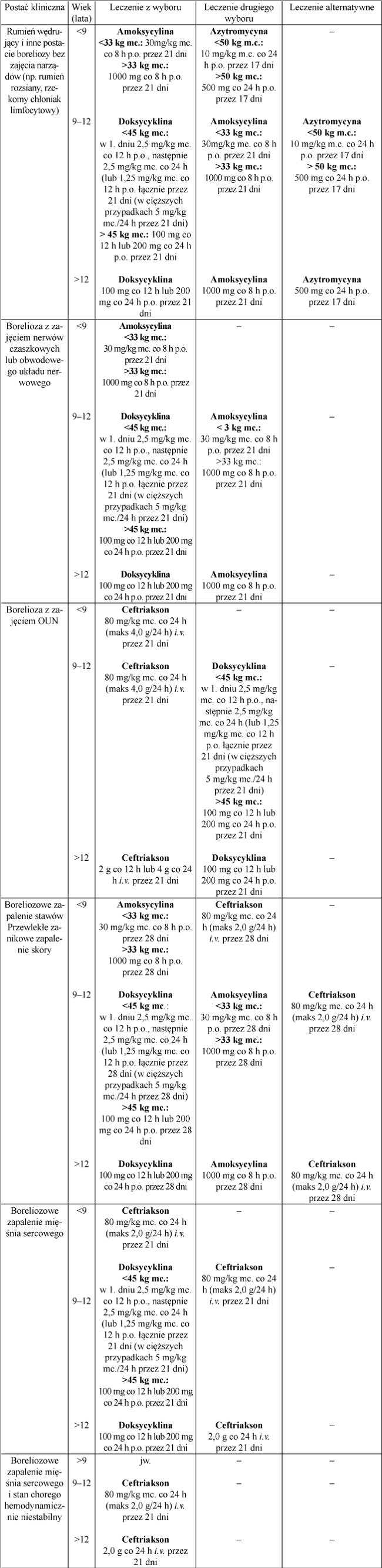
W Polsce boreliozę leczy się według wytycznych Polskiego Towarzystwa Epidemiologów
i Lekarzy Chorób Zakaźnych (PTELChZ) z 2018 r. Schemat leczenia jest bardzo zbliżony do rekomendacji NICE z 2018 r., ma jednak kilka różnic. Za lek pierwszego wyboru w leczeniu rumienia wędrującego i innych postaci boreliozy bez zajęcia narządów, uznano – oprócz amoksycyliny i doksycykliny – aksetyl cefuroksymu w dawce 15 mg/kg mc. p.o. co 12 h (maksymalnie 500 mg co 12 h). PTELChZ za lek pierwszego wyboru w leczeniu wczesnych postaci neuroboreliozy uznaje ceftriakson (dawka jak w postaci z zajęciem OUN). W wytycznych PTELChZ odmienne jest również leczenie zapalenia stawów. Nie zaleca ono amoksycyliny jako leczenie pierwszego wyboru, a ceftriakson lub doksycykline.
Należy zwrócić uwagę, że pomimo braku w Polsce formalnej rejestracji doksycykliny u dzieci powyżej 9. roku życia, zastosowanie takiego schematu leczenia jest bezpieczną i uznaną praktyką we wskazaniach. W zapaleniu mięśnia sercowego nie należy stosować azytromycny, ponieważ wydłuża odstęp QT i może powodować ciężkie zaburzenia rytmu serca.
Pomimo skutecznie przeprowadzonego leczenia boreliozy chorzy mogą zgłaszać występowanie utrzymujących się miesiącami niespecyficznych objawów, takich jak: uczucie osłabienia, ból głowy, bóle mięśni i stawów, zaburzenia funkcji poznawczych. Nie są do końca znane przyczyny tych objawów. Przypuszcza się, że mogą być wynikiem trwałego uszkodzenia tkanek przez krętki lub występowania reakcji immunologicznej przeciwko Borrelia sp. [19].
Minęło 36 lat od czasu wykrycia swoistych przeciwciał przeciwko Borrelia burgdorferii
i wykorzystania ich w diagnostyce boreliozy. Pomimo rozwoju metod diagnostycznych, opracowania wytycznych dotyczących leczenia, choroba ta nadal pozostaje wyzwaniem dla lekarzy, których wysiłki kierowane są w stronę zwiększenia skuteczności leczenia [20].
Lek. med. Karolina Sidorowska
Piśmiennictwo
1. Flieger J. Borelioza z Lyme. Przew Lek 2001;68:86-89.
2. Kmieciak W., Ciszewski M., Szewczyk E.M. Tick-borne diseases in Poland: Prevalence and dificulties in diagnostics. Med. Pr. 2016; 67: 73-87.
3. Krzyczmanik D., Sińczuk-Walczak H., Wittczak T., Cyran A., Pałczyński D., Walusiak-Skorupa J. Borelioza w praktyce Lekarza Medycyny Pracy. Med. Pr. 2012; 63: 483-492.
4. Garlicki A. Współczesne leczenie poreliozy z Lyme. Przegl Epidemiol 2007;61:449-456
5. Aguero-Rosenfeld ME, Wang G, Schwartz I, Wormser GP. Diagnosis of Lyme borreliosis. Clin Mirobiol Rev 2005;18:484-509.
6. Wilske B, Fingerie V, Schulte-Spechtel U. Microbiological and serological diagnosis of Lyme borreliosis. FEMS Immunol Med Microbiol 2007;49:13-21.
7. Savely GR. Update on Lyme Disease. Clin Rev 2006;16:45-50
8. Schnarr S. Lyme borreliosis. Best practice and Res Clin Rheumatol 2006;20:1099-1118.
9. Legatowicz-Koprowska M, Gziut Al, Jezierski J i wsp. Chorzy trudni nietypowi. Borelioza serca. Kardiol Pol 2007;65:1228-1230.
10. Steere A.C. Lyme disease. N. Engl. J. Med 2001; 345: 115.
11. Steere A.C., Broderick T.F., Malawista S.E. Erythema chronicum migrans and Lyme arthritis: epidemiologic evidence for a tick vector. Am. J. Epidemiol 1978; 108: 312-321.
12. Smoleńska Ż., Matyjasek A., Zdrojewski Z., Borelioza – najnowsze rekomendacje w diagnostyce i leczeniu. Forum Reumatol. 2016; 2: 58-64.
13. Ljostad U., Mygland A. Chronic Lyme; diagnostic challenges. Acta Neurol. Scand. 2013; 127 (supl. 196): 38-47.
14. Jansweijer J.A., van Oort R.J. Tricky ticks: the importance of Lyme carditis recognition. Neth. Heart J. 2015; 23: 531-532.
15. Szewczyk A.E., Kaszuba A., Bienias W. i wsp. W kleszczach boreliozy. Część II: Epidemiologia i obraz kliniczny. Dermatol. Prakt. 2013; 3: 13-21.
16. Shapiro E.D.: Borrelia burgdorferi (Lyme disease). (W:) Long S.S., Prober Ch.G., Fischer M. (red.): Principles and Practice of Pediatric Infectious Diseases. Wyd. 5, Elsevier, Philadelphia, 2018: 980–985.
17. Committee on Infectious Diseases; American Academy of Pediatrics: Lyme disease. (W:) Kimberlin D.W., Brady M.T., Jackson M.A., Long S.S. (red.): Red Book 2018. Wyd. 31, American Academy of Pediatrics, Itasca, 2018: 515–523.
18. Flisiak R, Pncewicz S. Diagnostyka i leczenie boreliozy z Lyme. Rekomendacje Polskiego Towarzystwa Epidemiologów i Lekarzy Chorób Zakaźnych. Przegl Epidemiol 2008;62:193-199.
19. Karlsson M., Hovind H.K, Svenungsson B., Stiernstedt G. Cultivation and characterization of spirochetes from cerebrospinal fluid of patients with Lyme borreliosis. J. Clin. Microbiol. 1990; 28: 473-479.
20. Pawińska A. Borelioza z Lyme – diagnostyka mikrobiologiczna i leczenie. Standardy medyczne/Pediatria. 2009;T.6:757-766.
W ostatnim czasie zaobserwowano gwałtowny wzrost zachorowań na choroby przenoszone przez kleszcze (ang. tick-borne diseases, TBD). Przyczyną są zmiany klimatyczne związane z ogólnym ociepleniem, krótkie zimy, wilgotne i długie lata, rozwój turystyki oraz zamiany stylu życia związane z aktywnymi formami wypoczynku wśród przyrody i roślinności [2].
Kleszcze, żywiąc się krwią zwierząt, ulegają zakażeniu bakteriami. Krętki rozwijają się w jelicie cienkim kleszcza, przenikają do krwi, a następnie w ostateczności do jego gruczołów ślinowych. Człowiek może ulec zakażeniu w trakcie ukąszenia przez kleszcza. Do transmisji może także dojść poprzez wtarcie w zranione miejsce na skórze rozgniecionego owada lub jego treści, kału. Czas,
w którym dochodzi do zakażenia, to maksymalnie 48 godzin od narażenia [3]. Wraz z czasem żerowania kleszcza na skórze ryzyko infekcji rośnie. Jeżeli przebywa on krócej niż jedną dobę, prawdopodobieństwo zakażenia jest niewielkie, ale po 72 godzinach rośnie nawet do 100% [1, 4].
Wiele różnych gatunków wchodzi w skład kompleksu Borrelia burgdorferii sensu lato. W zakażeniach u ludzi dominują trzy. Są to: Borrelia burgdorferii sensu stricto, Borrelia garinii i Borrelia afzelii [5, 6].
Borrelia burgdoferii wykazuje powinowactwo do trzech układów: tkanki łącznej, tkani mięśniowej
i tkanki nerwowej. Choroba może zająć skórę, układ mięśniowo-szkieletowy, oczy, serce, ośrodkowy i obwodowy układ nerwowy. To doprowadza do różnorodnych objawów klinicznych. Borelioza zazwyczaj przebiega w 3 stadiach:
1. Wczesna miejscowa – zwykle występuje rumień wędrujący, rzadziej rzekomy chłoniak limfocytowy skóry. Czasami to stadium mija niezauważone, a choroba ujawnia się dopiero w fazie rozsianej;
2. Wczesnia rozsiana – zajęcie układu nerwowego (neuroborelioza), rzadziej zajęcie mięśnia sercowego, zapalenie stawów;
3. Późna przewlekła – powyżej jednego roku od zakażenia, rzadko występuje u dzieci, dochodzi do trwałego uszkodzenia układu nerwowego, oka, układu ruchu [7–9].
Rumień wędrujący przypomina plamkę lub grudkę z centralnym przejaśnieniem i może osiągać różne rozmiary. U dzieci najczęściej występuje na skórze głowy i szyi [10]. W niektórych przypadkach dochodzi do powstania wczesnej rozsianej skórnej postaci boreliozy, zwanej rumieniem wędrującym mnogim. Przyczyną jest rozsiew krętków za pomocą krwi lub chłonki do dalej położonych obszarów skóry [11]. Należy pamiętać, że brak rumienia wędrującego
w wywiadzie nie wyklucza rozpoznania boreliozy [12].
Neuroborelioza to zmiany patologiczne, którym towarzyszą objawy pochodzące z różnych struktur centralnego i obwodowego układu nerwowego. Choroba może manifestować się bólami głowy, sztywnością karku oraz łagodną enceflopatią. Ostre objawy mogą ustąpić samoistnie bez leczenia [13].
Postać sercowa u dzieci występuje bardzo rzadko, zaś w populacji ogólnej u około 5% chorych. Obecnie rzadko dochodzi do zapalenia serca, ponieważ choroba jest szybciej rozpoznawana i skuteczniej leczona. Postać ta może manifestować się jako zapalenie mięśnia sercowego i/lub osierdzia/wsierdzia, zaburzenia przewodnictwa, migotanie przedsionków lub częstoskurcz. Następstwem zapalenia serca może być kardiomiopatia [14].
Przebieg kliniczny zmian dotyczących układu mięśniowo-stawowego ma charakter nawracający
z ostrymi napadami zapalenia i remisji. Choroba najczęściej zajmuje stawy: kolanowe, skokowe, biodrowe, łokciowe, nadgarstkowe, rzadziej drobne stawy rąk, stóp czy stawy skroniowo-żuchwowe.
Borelioza może również dawać niespecyficzne objawy ogólne oraz problemy diagnostyki laboratoryjnej. Do nieswoistych objawów ogólnych zalicza się: osłabienie, napadowe bóle karku, upośledzenie termoregulacji, zaburzenia narządu słuchu i wzroku, zaburzenia poznawcze [15]. Podczas zachorowania bardzo często nie występują wszystkie objawy. Większość dzieci jest diagnozowana w stadium wczesnym ograniczonym (głównie występuje rumień wędrujący) lub wczesnym rozsianym (najczęściej rozpoznawane jest zapalenie opon mózgowo-rdzeniowych i/lub porażenie nerwu twarzowego). Niektóre objawy poszczególnych stadiów choroby występują razem.
Jeżeli u dzieci nie zastosowano antybiotykoterapii, objawy ustępują samoistnie do 12 tygodni. Należy jednak pamiętać, że do kilku miesięcy od zakażenia mogą pojawić się objawy wskazujące na stadium wczesne rozsiane. Dalszy przebieg choroby manifestuje się zmiennością nasilenia objawów i wielokrotnymi nawrotami. Jeśli chory nie będzie leczony, występuje ryzyko utrzymywania się dolegliwości przez kilka lat. Może również dojść do rozwoju przewlekłych objawów późnego stadium [16, 17].
Rozpoznanie boreliozy na podstawie obrazu klinicznego bywa trudne. W wielu przypadkach nie stwierdza się rumienia wędrującego, brak w wywiadzie informacji o ukąszeniu kleszcza, a jednoczasowe występowanie wszystkich możliwych objawów boreliozy zdarza się bardzo rzadko. W tych sytuacjach potrzebna jest diagnostyka laboratoryjna. Nie ma jednoznacznego testu diagnostycznego dla boreliozy, ponieważ antygen bakterii jest zmienny i ma złożoną budowę. Mimo to w wielu przypadkach dostępne metody pozwalają na potwierdzenie rozpoznania
i zastosowanie skutecznej terapii. Wśród badań diagnostycznych należy wymienić detekcje przeciwciał IgG i IgM metodami ELISA/Western blot. Dodatkowo zastosowanie mają diagnostyka biologii molekularnej (PCR, badanie histopatologiczne wycinka skóry, badanie płynu mózgowo-rdzeniowego, badanie płynu stawowego) [12].
Podstawą leczenia boreliozy jest antybiotykoterapia. Decyzję o rozpoczęciu leczenia należy podjąć wtedy, gdy pacjent prezentuje objawy kliniczne. Błędem jest zastosowanie antybiotyku tylko na podstawie dodatniego badania serologicznego bez manifestacji objawów klinicznych [18]. Poniżej w tabeli przedstawiono zasady leczenia boreliozy u dzieci i młodzieży według aktualnych wytycznych NICE z 2018 r.
Tabela 1. Zasady leczenia boreliozy u dzieci i młodzieży według wytycznych NICE z 2018 r.

W Polsce boreliozę leczy się według wytycznych Polskiego Towarzystwa Epidemiologów
i Lekarzy Chorób Zakaźnych (PTELChZ) z 2018 r. Schemat leczenia jest bardzo zbliżony do rekomendacji NICE z 2018 r., ma jednak kilka różnic. Za lek pierwszego wyboru w leczeniu rumienia wędrującego i innych postaci boreliozy bez zajęcia narządów, uznano – oprócz amoksycyliny i doksycykliny – aksetyl cefuroksymu w dawce 15 mg/kg mc. p.o. co 12 h (maksymalnie 500 mg co 12 h). PTELChZ za lek pierwszego wyboru w leczeniu wczesnych postaci neuroboreliozy uznaje ceftriakson (dawka jak w postaci z zajęciem OUN). W wytycznych PTELChZ odmienne jest również leczenie zapalenia stawów. Nie zaleca ono amoksycyliny jako leczenie pierwszego wyboru, a ceftriakson lub doksycykline.
Należy zwrócić uwagę, że pomimo braku w Polsce formalnej rejestracji doksycykliny u dzieci powyżej 9. roku życia, zastosowanie takiego schematu leczenia jest bezpieczną i uznaną praktyką we wskazaniach. W zapaleniu mięśnia sercowego nie należy stosować azytromycny, ponieważ wydłuża odstęp QT i może powodować ciężkie zaburzenia rytmu serca.
Pomimo skutecznie przeprowadzonego leczenia boreliozy chorzy mogą zgłaszać występowanie utrzymujących się miesiącami niespecyficznych objawów, takich jak: uczucie osłabienia, ból głowy, bóle mięśni i stawów, zaburzenia funkcji poznawczych. Nie są do końca znane przyczyny tych objawów. Przypuszcza się, że mogą być wynikiem trwałego uszkodzenia tkanek przez krętki lub występowania reakcji immunologicznej przeciwko Borrelia sp. [19].
Minęło 36 lat od czasu wykrycia swoistych przeciwciał przeciwko Borrelia burgdorferii
i wykorzystania ich w diagnostyce boreliozy. Pomimo rozwoju metod diagnostycznych, opracowania wytycznych dotyczących leczenia, choroba ta nadal pozostaje wyzwaniem dla lekarzy, których wysiłki kierowane są w stronę zwiększenia skuteczności leczenia [20].
Lek. med. Karolina Sidorowska
Piśmiennictwo
1. Flieger J. Borelioza z Lyme. Przew Lek 2001;68:86-89.
2. Kmieciak W., Ciszewski M., Szewczyk E.M. Tick-borne diseases in Poland: Prevalence and dificulties in diagnostics. Med. Pr. 2016; 67: 73-87.
3. Krzyczmanik D., Sińczuk-Walczak H., Wittczak T., Cyran A., Pałczyński D., Walusiak-Skorupa J. Borelioza w praktyce Lekarza Medycyny Pracy. Med. Pr. 2012; 63: 483-492.
4. Garlicki A. Współczesne leczenie poreliozy z Lyme. Przegl Epidemiol 2007;61:449-456
5. Aguero-Rosenfeld ME, Wang G, Schwartz I, Wormser GP. Diagnosis of Lyme borreliosis. Clin Mirobiol Rev 2005;18:484-509.
6. Wilske B, Fingerie V, Schulte-Spechtel U. Microbiological and serological diagnosis of Lyme borreliosis. FEMS Immunol Med Microbiol 2007;49:13-21.
7. Savely GR. Update on Lyme Disease. Clin Rev 2006;16:45-50
8. Schnarr S. Lyme borreliosis. Best practice and Res Clin Rheumatol 2006;20:1099-1118.
9. Legatowicz-Koprowska M, Gziut Al, Jezierski J i wsp. Chorzy trudni nietypowi. Borelioza serca. Kardiol Pol 2007;65:1228-1230.
10. Steere A.C. Lyme disease. N. Engl. J. Med 2001; 345: 115.
11. Steere A.C., Broderick T.F., Malawista S.E. Erythema chronicum migrans and Lyme arthritis: epidemiologic evidence for a tick vector. Am. J. Epidemiol 1978; 108: 312-321.
12. Smoleńska Ż., Matyjasek A., Zdrojewski Z., Borelioza – najnowsze rekomendacje w diagnostyce i leczeniu. Forum Reumatol. 2016; 2: 58-64.
13. Ljostad U., Mygland A. Chronic Lyme; diagnostic challenges. Acta Neurol. Scand. 2013; 127 (supl. 196): 38-47.
14. Jansweijer J.A., van Oort R.J. Tricky ticks: the importance of Lyme carditis recognition. Neth. Heart J. 2015; 23: 531-532.
15. Szewczyk A.E., Kaszuba A., Bienias W. i wsp. W kleszczach boreliozy. Część II: Epidemiologia i obraz kliniczny. Dermatol. Prakt. 2013; 3: 13-21.
16. Shapiro E.D.: Borrelia burgdorferi (Lyme disease). (W:) Long S.S., Prober Ch.G., Fischer M. (red.): Principles and Practice of Pediatric Infectious Diseases. Wyd. 5, Elsevier, Philadelphia, 2018: 980–985.
17. Committee on Infectious Diseases; American Academy of Pediatrics: Lyme disease. (W:) Kimberlin D.W., Brady M.T., Jackson M.A., Long S.S. (red.): Red Book 2018. Wyd. 31, American Academy of Pediatrics, Itasca, 2018: 515–523.
18. Flisiak R, Pncewicz S. Diagnostyka i leczenie boreliozy z Lyme. Rekomendacje Polskiego Towarzystwa Epidemiologów i Lekarzy Chorób Zakaźnych. Przegl Epidemiol 2008;62:193-199.
19. Karlsson M., Hovind H.K, Svenungsson B., Stiernstedt G. Cultivation and characterization of spirochetes from cerebrospinal fluid of patients with Lyme borreliosis. J. Clin. Microbiol. 1990; 28: 473-479.
20. Pawińska A. Borelioza z Lyme – diagnostyka mikrobiologiczna i leczenie. Standardy medyczne/Pediatria. 2009;T.6:757-766.