3 NS - aktualne wytyczne postępowania, grupy leków, kolejność ich wdrażania oraz dawkowanie
Autor: Redakcja serwisu
Niewydolność serca jest jedną z częstszych przyczyn zgonów sercowo-naczyniowych. Szacuje się, że w skali roku z tego powodu umiera co dziesiąty pacjent z takim rozpoznaniem, a czwarta klasa NYHA oznacza prawie pięćdziesięcioprocentowe ryzyko zgonu (1). Należy zaznaczyć, iż prawie każda choroba serca w swym naturalnym przebiegu, prędzej czy później, może doprowadzić do niewydolności. Najczęściej są to jednak: choroba niedokrwienna serca (ChNS), nadciśnienie tętnicze (NT), wady zastawkowe czy różnego rodzaju kardiomiopatie. Według statystyk, skuteczne leczenie dotyczy tylko ok. 8–11% chorych (2). W związku z częstością występowania niewydolności serca, farmakoterapia w tej grupie chorych jest jednym z istotniejszych tematów w kardiologii. Celem leczenia jest zmniejszenie śmiertelności, częstości hospitalizacji z powodu niewydolności serca i poprawa jakości życia pacjenta. Należy pamiętać, iż nowoczesne leczenie tego schorzenia to obecnie połączenie trzech obszarów: terapii niefarmakologicznej, farmakologii i leczenia zabiegowego.
Epidemiologia
Zarówno w gabinecie lekarza rodzinnego, specjalisty oraz na różnych oddziałach szpitalnych pacjent z niewydolnością serca pojawia się regularnie. Częstość występowania niewydolności serca w Europie i w USA szacuje się na ok. 1–4% społeczeństwa (3). Istotnym problemem są koszty leczenia tej grupy chorych. O ile w Polsce nie ma precyzyjnych danych, to w USA jest to ok. 35 mld dolarów rocznie (w roku 2008), co stanowi kwotę wyższą niż leczenie schorzeń nowotworowych (4). W naszym kraju prawdopodobnie ilość chorych z niewydolnością serca to ok. 1 mln. Umieralność z tego powodu jest porównywalna z nowotworami – zarówno wśród mężczyzn, jak i kobiet.
Aktualna farmakoterapia
Schemat leczenia farmakologicznego w niewydolności serca został ostatnio zmodyfikowany w aktualnych wytycznych, w związku z nowymi doniesieniami z badań naukowych i pojawieniem się nowych opcji terapeutycznych (5). Leki stosowane w terapii mają za zadanie zablokować konkretne zjawiska patofizjologiczne zachodzące w organizmie. Blokowanie układu renina-angiotensyna-aldosteron (RAA) na różnych poziomach jest jednym z najważniejszych elementów farmakoterapii. Od ok. 20–30 lat mamy dowody naukowe na skuteczność inhibitorów konwertazy angiotensyny (ACEI). Badania takie jak: CONSENSUS (enalapril), SOLVD-Treatment (enalapril), SAVE (captopril), AIRE (ramipril), czy TRACE (trandolapril) dały podstawy do stosowania ACEI w niewydolności serca. Leki z tej grupy mogą wpływać pozytywnie na niekorzystną przebudowę miokardium, zmniejszają retencję płynów i poprawiają jakość życia pacjenta.
Badania RALES i EPHESUS wykazały skuteczność spironolaktonu i eplerenonu w niewydolności serca. W badaniu RALES udowodniono, iż spironolakton w dawce 25 lub 50 mg zmniejsza śmiertelności z jakiejkolwiek przyczyny o 30% w porównaniu z placebo, o 30% redukuje częstość hospitalizacji z przyczyn sercowo-naczyniowych i o 35% zmniejsza częstość hospitalizacji z powodu zaostrzenia niewydolności serca (6). Z kolei w badaniu EPHESUS stwierdzono redukcję zgonu z jakiejkolwiek przyczyny o 15% dla grupy leczonej eplerenonem oraz o 15% mniejszą częstość hospitalizacji z powodu niewydolności serca (7).
Dopiero po koniec lat 90-tych w badaniu CIBIS II udowodniono, iż bisoprolol jest skuteczny w leczeniu niewydolności serca, wcześniej leki z grupy beta-blokerów były wręcz przeciwwskazane w tym schorzeniu. W grupie leczonej bisoprololem, aż o 32% rzadziej stwierdzano zgony z jakiejkolwiek przyczyny, a epizody hospitalizacji z powodu zaostrzenia niewydolności serca występowały rzadziej o 36% w porównaniu z grupą otrzymującą placebo (8). W dużych randomizowanych próbach klinicznych oceniających karwedilol, metoprolol (badania odpowiednio: COPERNICUS i MERIT-HF) stwierdzano mniejszą śmiertelność o ok. 34–35% z powodu niewydolności serca w grupach aktywnie leczonych w porównaniu z placebo. W badaniu SENIORS (nebiwolol) ta redukcja śmiertelności wyniosła 14% (9–11).
Po badaniu SHIFT do farmakoterapii w niewydolności serca dołączyła iwabradyna. Na grupie 6,5 tysięcy chorych z niewydolnością serca z obniżoną frakcją wyrzutową lewej komory wykazano, iż iwabradyna istotnie redukuje częstość zgonów z przyczyn sercowo-naczyniowych i hospitalizacji z powodu zaostrzenia niewydolności serca (o ok. 18%) (12).
Sporą nowością i zarazem pewną nadzieją na jeszcze większą poprawę rokowania chorych z niewydolnością serca były wyniki badania PARDIGM-HF dla skojarzenia dwóch substancji: walsartanu i sakubitrylu. Połączenie znanego już mechanizmu działania sartanu (blokowanie układu RAA) i nowego (inhibitor dla neprylizyny) spowodowało dalszą redukcję śmiertelności i hospitalizacji z powodu niewydolności serca o 20% (badanie przerwano przedwcześnie, gdyż nowy lek w porównaniu z enalaprilem okazał się bardziej skuteczny) (13).
Aktualny schemat leczenia farmakologicznego niewydolności serca przedstawiono na schemacie 1. Należy zwrócić uwagę na dwa aspekty: po pierwsze podstawowymi lekami w tej grupie chorych są leki wpływające na rokowanie (przedłużające życie), a więc beta-blokery, ACEI (lub sartany), antagoniści aldosteronu, iwabradyna lub walsartan z sakubitrylem; po drugie na każdym etapie możemy dołączyć, zredukować lub odstawić leki objawowe, czyli diuretyki. Z powyższego wynika, że każdy chory – przy braku przeciwwskazań – powinien mieć włączone ww. leki poprawiające rokowanie, a diuretyk tylko gdy jest konieczny. Co więcej, badania kliniczne dot. poszczególnych preparatów jasno wykazały, że największą korzyść pacjent odnosi z maksymalnych (optymalnych) dawek tych leków. Rzecz jasna dawka zależy od takich parametrów, jak: ciśnienie tętnicze, tętno, klirens kreatyniny, poziom potasu i inne, jednakże należy dążyć do maksymalnych tolerowanych przez chorego dawek, których skuteczność została potwierdzona w badaniach. W praktyce częstą sytuacją jest stosowanie dużych dawek diuretyku u chorego z już niskim ciśnieniem tętniczym, co niesie ze sobą brak możliwości zwiększenia lub włączenia np. ACEI, z uwagi na tendencję do hipotonii. Tymczasem zredukowanie dawki lub nawet odstawienie diuretyku mogłoby umożliwić leczenie poprawiające rokowanie.
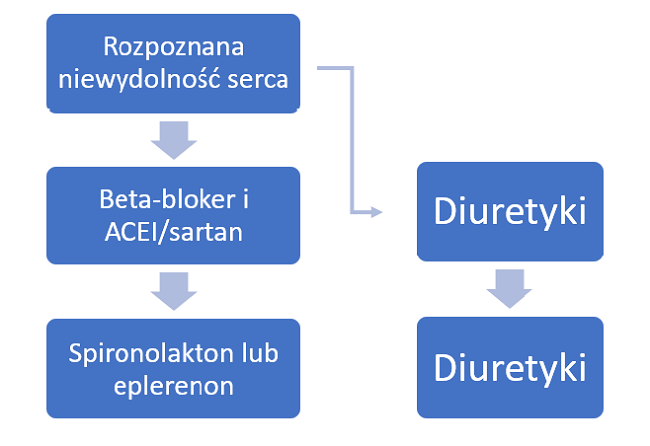
Schemat 1. Aktualny schemat leczenia farmakologicznego niewydolności serca.
W przypadku braku poprawy objawów lub/i frakcji wyrzutowej postępowanie powinno wyglądać jak na schemacie poniżej:
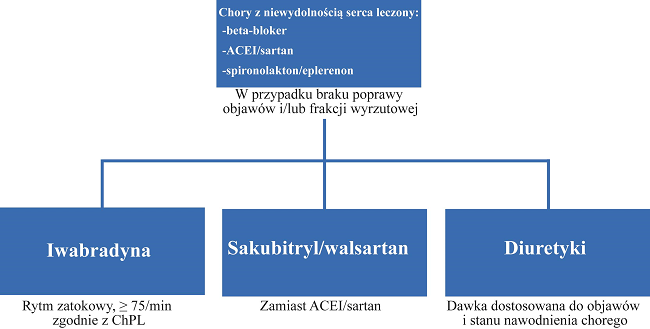
Schemat 2. Aktualny schemat leczenia farmakologicznego niewydolności serca.
Początek farmakoterapii
Terapię zaczynamy od małych dawek ACEI i beta-blokera, które stopniowo zwiększamy. Równocześnie celem zmniejszenia objawów (duszność, obrzęki itp.) stosujemy diuretyki. W przypadku braku poprawy (utrzymujące się objawy, brak poprawy frakcji wyrzutowej lewej komory) dostosowujemy dawki diuretyków, jednocześnie optymalizując leczenie beta-blokerem i ACEI. W następnym kroku dołączamy antagonistę aldosteronu. W przypadku ACEI/sartanu i antagonisty aldosteronu należy pamiętać o okresowej kontroli parametrów nerkowych i potasu. Na początku leczenia wzrost poziomu kreatyniny do ok. 50%, w porównaniu z wartościami wyjściowymi, do 266 μmol/l (3 mg/dl) lub spadek szacowanego GFR <25 ml/min/1,73 m2 (wystąpienie któregokolwiek z kryteriów) jest akceptowalny i nie wymaga odstawiania leku. U chorego, który w dalszym ciągu prezentuje objawy kliniczne niewydolności serca lub frakcja wyrzutowa nie poprawia się, należy wziąć pod uwagę dwa kolejne leki: iwabradynę lub/i walsartan/sakubitryl zamiast ACEI/sartanu. Iwabradynę można dołączyć do już stosowanego beta-blokera (należy pamiętać o kryteriach akcji serca i rytmie zatokowym) lub stosować zamiast beta-blokera w przypadku jego nietolerancji. Sakubitryl/walsartan włączamy zamiast ACEI/sartanu, pozostałe leki można pozostawić bez zmian. Dawkowanie, a zwłaszcza docelowe dawki ww. leków, można znaleźć w wytycznych (5).
Digoksyna jest obecnie lekiem zarezerwowanym dla wybranych grup chorych. Przede wszystkim stosujemy ją u pacjentów z migotaniem przedsionków (zwłaszcza utrwalonym) celem kontroli częstości rytmu serca. Zasadniczą wadą jest konieczność kontroli jej poziomu we krwi ze względu na wąski przedział terapeutyczny.
Leczenie niefarmakologiczne
Należy podkreślić olbrzymią rolę postępowania niefarmakologicznego – począwszy od przeszkolenia pacjenta w kwestii regularnej kontroli masy ciała (codzienne ważenie się), diety (w tym przyjmowania płynów i spożycia soli kuchennej), pomiarów ciśnienia oraz tętna, aż po ewentualne, samodzielne modyfikacje dawek diuretyków (w przypadku wzrostu masy ciała w krótkim odstępie czasu). Takie działania mogą znacząco zredukować częstość hospitalizacji, a nawet wizyt w gabinecie lekarza rodzinnego.
Podsumowanie
Aktualne wytyczne postępowania w niewydolności serca jasno precyzują grupy leków, kolejność ich wdrażania oraz dawkowanie u pacjentów z tym schorzeniem. Optymalizacja dawek leków wpływających na rokowanie jest kluczowa, gdyż przedłuża życie chorym i poprawia jego jakość. Jednak pamiętajmy, iż każda farmakoterapia musi być zindywidualizowana w zależności od schorzeń współistniejących i stanu pacjenta.

Tabela 1. Względna redukcja ryzyka zgonu dla poszczególnych leków w niewydolności serca. Na podstawie (14).
Dr n. med. Piotr Kusak
Zobacz także wykład prof. dr hab. n. med. Andrzeja Szyszki:
Niewydolność serca - leczenie

Piśmiennictwo:
1. Dubiel J., i wsp. Niewydolność serca, Gdańsk 2004.
2. Bandosz P., i wsp. Bieżąca analiza czynników społecznych, ekonomicznych i socjologicznych oraz ich potencjalnego związku ze wskaźnikami zachorowalności oraz umieralności na choroby układu sercowo-naczyniowego w Polsce.
3. MacDonald M., et al. Diabetes, left ventricular systolic dysfunction and chronic heart failure European Heart Journal 2008;1224-1240.
4. Rosamond W. et al. Heart Disease and Stroke Statistics 2008 Update: A Report From the American Heart Association Statistics Committee and Stroke Statistics Subcommittee Circulation 2008;117;e25-e146.
5. Ponikowski P, i wsp. Wytyczne ESC dotyczące diagnostyki i leczenia ostrej i przewlekłej niewydolności serca w 2016 roku. Kardiologia Polska 2016; 74: 1037–1147.
6. BERTRAM P. et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure N Engl J Med 1999;341:709-717.
7. BERTRAM P. et al. Eplerenone, a Selective Aldosterone Blocker, in Patients with Left Ventricular Dysfunction after Myocardial Infarction N Engl J Med 2003;348:1309-1321.
8. CIBIS-II Investigators The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomised trial. The Lancet 1999;353(9146):9-13.
9. Wollert K., Drexler H. Carvedilol Prospective Randomized Cumulative Survival (COPERNICUS) Trial: Carvedilol as the Sun and Center of the ß-Blocker World? Circulation 2002;106;2164-2166.
10. MERIT-HF Study Group Effects of Controlled-Release Metoprolol on Total Mortality, Hospitalizations, and Well-being in Patients With Heart Failure The Metoprolol CR/XL Randomized Intervention Trial in Congestive Heart Failure (MERIT-HF) JAMA 2000;283:1295-1302.
11. Ghio S. et al. Effects of nebivolol in elderly heart failure patients with or without systolic left ventricular dysfunction: results of the SENIORS echocardiographic substudy EurHeart J 2006;27:562–568.
12. Swedberg K., et al. Ivabradine and outcomes in chronic heart failure (SHIFT): a randomised placebo-controlled study. Lancet 2010;376:875-885.
13. McMurray J., et al. Angiotensin–Neprilysin Inhibition versus Enalapril in Heart Failure. Engl J Med 2014; 371:993-1004.
14. Fonarow G. et al. Lancet 2008; August 31, DOI:10.1016/S0140-6736(08)61241-6.
Epidemiologia
Zarówno w gabinecie lekarza rodzinnego, specjalisty oraz na różnych oddziałach szpitalnych pacjent z niewydolnością serca pojawia się regularnie. Częstość występowania niewydolności serca w Europie i w USA szacuje się na ok. 1–4% społeczeństwa (3). Istotnym problemem są koszty leczenia tej grupy chorych. O ile w Polsce nie ma precyzyjnych danych, to w USA jest to ok. 35 mld dolarów rocznie (w roku 2008), co stanowi kwotę wyższą niż leczenie schorzeń nowotworowych (4). W naszym kraju prawdopodobnie ilość chorych z niewydolnością serca to ok. 1 mln. Umieralność z tego powodu jest porównywalna z nowotworami – zarówno wśród mężczyzn, jak i kobiet.
Aktualna farmakoterapia
Schemat leczenia farmakologicznego w niewydolności serca został ostatnio zmodyfikowany w aktualnych wytycznych, w związku z nowymi doniesieniami z badań naukowych i pojawieniem się nowych opcji terapeutycznych (5). Leki stosowane w terapii mają za zadanie zablokować konkretne zjawiska patofizjologiczne zachodzące w organizmie. Blokowanie układu renina-angiotensyna-aldosteron (RAA) na różnych poziomach jest jednym z najważniejszych elementów farmakoterapii. Od ok. 20–30 lat mamy dowody naukowe na skuteczność inhibitorów konwertazy angiotensyny (ACEI). Badania takie jak: CONSENSUS (enalapril), SOLVD-Treatment (enalapril), SAVE (captopril), AIRE (ramipril), czy TRACE (trandolapril) dały podstawy do stosowania ACEI w niewydolności serca. Leki z tej grupy mogą wpływać pozytywnie na niekorzystną przebudowę miokardium, zmniejszają retencję płynów i poprawiają jakość życia pacjenta.
Badania RALES i EPHESUS wykazały skuteczność spironolaktonu i eplerenonu w niewydolności serca. W badaniu RALES udowodniono, iż spironolakton w dawce 25 lub 50 mg zmniejsza śmiertelności z jakiejkolwiek przyczyny o 30% w porównaniu z placebo, o 30% redukuje częstość hospitalizacji z przyczyn sercowo-naczyniowych i o 35% zmniejsza częstość hospitalizacji z powodu zaostrzenia niewydolności serca (6). Z kolei w badaniu EPHESUS stwierdzono redukcję zgonu z jakiejkolwiek przyczyny o 15% dla grupy leczonej eplerenonem oraz o 15% mniejszą częstość hospitalizacji z powodu niewydolności serca (7).
Dopiero po koniec lat 90-tych w badaniu CIBIS II udowodniono, iż bisoprolol jest skuteczny w leczeniu niewydolności serca, wcześniej leki z grupy beta-blokerów były wręcz przeciwwskazane w tym schorzeniu. W grupie leczonej bisoprololem, aż o 32% rzadziej stwierdzano zgony z jakiejkolwiek przyczyny, a epizody hospitalizacji z powodu zaostrzenia niewydolności serca występowały rzadziej o 36% w porównaniu z grupą otrzymującą placebo (8). W dużych randomizowanych próbach klinicznych oceniających karwedilol, metoprolol (badania odpowiednio: COPERNICUS i MERIT-HF) stwierdzano mniejszą śmiertelność o ok. 34–35% z powodu niewydolności serca w grupach aktywnie leczonych w porównaniu z placebo. W badaniu SENIORS (nebiwolol) ta redukcja śmiertelności wyniosła 14% (9–11).
Po badaniu SHIFT do farmakoterapii w niewydolności serca dołączyła iwabradyna. Na grupie 6,5 tysięcy chorych z niewydolnością serca z obniżoną frakcją wyrzutową lewej komory wykazano, iż iwabradyna istotnie redukuje częstość zgonów z przyczyn sercowo-naczyniowych i hospitalizacji z powodu zaostrzenia niewydolności serca (o ok. 18%) (12).
Sporą nowością i zarazem pewną nadzieją na jeszcze większą poprawę rokowania chorych z niewydolnością serca były wyniki badania PARDIGM-HF dla skojarzenia dwóch substancji: walsartanu i sakubitrylu. Połączenie znanego już mechanizmu działania sartanu (blokowanie układu RAA) i nowego (inhibitor dla neprylizyny) spowodowało dalszą redukcję śmiertelności i hospitalizacji z powodu niewydolności serca o 20% (badanie przerwano przedwcześnie, gdyż nowy lek w porównaniu z enalaprilem okazał się bardziej skuteczny) (13).
Aktualny schemat leczenia farmakologicznego niewydolności serca przedstawiono na schemacie 1. Należy zwrócić uwagę na dwa aspekty: po pierwsze podstawowymi lekami w tej grupie chorych są leki wpływające na rokowanie (przedłużające życie), a więc beta-blokery, ACEI (lub sartany), antagoniści aldosteronu, iwabradyna lub walsartan z sakubitrylem; po drugie na każdym etapie możemy dołączyć, zredukować lub odstawić leki objawowe, czyli diuretyki. Z powyższego wynika, że każdy chory – przy braku przeciwwskazań – powinien mieć włączone ww. leki poprawiające rokowanie, a diuretyk tylko gdy jest konieczny. Co więcej, badania kliniczne dot. poszczególnych preparatów jasno wykazały, że największą korzyść pacjent odnosi z maksymalnych (optymalnych) dawek tych leków. Rzecz jasna dawka zależy od takich parametrów, jak: ciśnienie tętnicze, tętno, klirens kreatyniny, poziom potasu i inne, jednakże należy dążyć do maksymalnych tolerowanych przez chorego dawek, których skuteczność została potwierdzona w badaniach. W praktyce częstą sytuacją jest stosowanie dużych dawek diuretyku u chorego z już niskim ciśnieniem tętniczym, co niesie ze sobą brak możliwości zwiększenia lub włączenia np. ACEI, z uwagi na tendencję do hipotonii. Tymczasem zredukowanie dawki lub nawet odstawienie diuretyku mogłoby umożliwić leczenie poprawiające rokowanie.

Schemat 1. Aktualny schemat leczenia farmakologicznego niewydolności serca.
W przypadku braku poprawy objawów lub/i frakcji wyrzutowej postępowanie powinno wyglądać jak na schemacie poniżej:

Schemat 2. Aktualny schemat leczenia farmakologicznego niewydolności serca.
Początek farmakoterapii
Terapię zaczynamy od małych dawek ACEI i beta-blokera, które stopniowo zwiększamy. Równocześnie celem zmniejszenia objawów (duszność, obrzęki itp.) stosujemy diuretyki. W przypadku braku poprawy (utrzymujące się objawy, brak poprawy frakcji wyrzutowej lewej komory) dostosowujemy dawki diuretyków, jednocześnie optymalizując leczenie beta-blokerem i ACEI. W następnym kroku dołączamy antagonistę aldosteronu. W przypadku ACEI/sartanu i antagonisty aldosteronu należy pamiętać o okresowej kontroli parametrów nerkowych i potasu. Na początku leczenia wzrost poziomu kreatyniny do ok. 50%, w porównaniu z wartościami wyjściowymi, do 266 μmol/l (3 mg/dl) lub spadek szacowanego GFR <25 ml/min/1,73 m2 (wystąpienie któregokolwiek z kryteriów) jest akceptowalny i nie wymaga odstawiania leku. U chorego, który w dalszym ciągu prezentuje objawy kliniczne niewydolności serca lub frakcja wyrzutowa nie poprawia się, należy wziąć pod uwagę dwa kolejne leki: iwabradynę lub/i walsartan/sakubitryl zamiast ACEI/sartanu. Iwabradynę można dołączyć do już stosowanego beta-blokera (należy pamiętać o kryteriach akcji serca i rytmie zatokowym) lub stosować zamiast beta-blokera w przypadku jego nietolerancji. Sakubitryl/walsartan włączamy zamiast ACEI/sartanu, pozostałe leki można pozostawić bez zmian. Dawkowanie, a zwłaszcza docelowe dawki ww. leków, można znaleźć w wytycznych (5).
Digoksyna jest obecnie lekiem zarezerwowanym dla wybranych grup chorych. Przede wszystkim stosujemy ją u pacjentów z migotaniem przedsionków (zwłaszcza utrwalonym) celem kontroli częstości rytmu serca. Zasadniczą wadą jest konieczność kontroli jej poziomu we krwi ze względu na wąski przedział terapeutyczny.
Leczenie niefarmakologiczne
Należy podkreślić olbrzymią rolę postępowania niefarmakologicznego – począwszy od przeszkolenia pacjenta w kwestii regularnej kontroli masy ciała (codzienne ważenie się), diety (w tym przyjmowania płynów i spożycia soli kuchennej), pomiarów ciśnienia oraz tętna, aż po ewentualne, samodzielne modyfikacje dawek diuretyków (w przypadku wzrostu masy ciała w krótkim odstępie czasu). Takie działania mogą znacząco zredukować częstość hospitalizacji, a nawet wizyt w gabinecie lekarza rodzinnego.
Podsumowanie
Aktualne wytyczne postępowania w niewydolności serca jasno precyzują grupy leków, kolejność ich wdrażania oraz dawkowanie u pacjentów z tym schorzeniem. Optymalizacja dawek leków wpływających na rokowanie jest kluczowa, gdyż przedłuża życie chorym i poprawia jego jakość. Jednak pamiętajmy, iż każda farmakoterapia musi być zindywidualizowana w zależności od schorzeń współistniejących i stanu pacjenta.

Tabela 1. Względna redukcja ryzyka zgonu dla poszczególnych leków w niewydolności serca. Na podstawie (14).
Dr n. med. Piotr Kusak
Zobacz także wykład prof. dr hab. n. med. Andrzeja Szyszki:
Niewydolność serca - leczenie

Piśmiennictwo:
1. Dubiel J., i wsp. Niewydolność serca, Gdańsk 2004.
2. Bandosz P., i wsp. Bieżąca analiza czynników społecznych, ekonomicznych i socjologicznych oraz ich potencjalnego związku ze wskaźnikami zachorowalności oraz umieralności na choroby układu sercowo-naczyniowego w Polsce.
3. MacDonald M., et al. Diabetes, left ventricular systolic dysfunction and chronic heart failure European Heart Journal 2008;1224-1240.
4. Rosamond W. et al. Heart Disease and Stroke Statistics 2008 Update: A Report From the American Heart Association Statistics Committee and Stroke Statistics Subcommittee Circulation 2008;117;e25-e146.
5. Ponikowski P, i wsp. Wytyczne ESC dotyczące diagnostyki i leczenia ostrej i przewlekłej niewydolności serca w 2016 roku. Kardiologia Polska 2016; 74: 1037–1147.
6. BERTRAM P. et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure N Engl J Med 1999;341:709-717.
7. BERTRAM P. et al. Eplerenone, a Selective Aldosterone Blocker, in Patients with Left Ventricular Dysfunction after Myocardial Infarction N Engl J Med 2003;348:1309-1321.
8. CIBIS-II Investigators The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomised trial. The Lancet 1999;353(9146):9-13.
9. Wollert K., Drexler H. Carvedilol Prospective Randomized Cumulative Survival (COPERNICUS) Trial: Carvedilol as the Sun and Center of the ß-Blocker World? Circulation 2002;106;2164-2166.
10. MERIT-HF Study Group Effects of Controlled-Release Metoprolol on Total Mortality, Hospitalizations, and Well-being in Patients With Heart Failure The Metoprolol CR/XL Randomized Intervention Trial in Congestive Heart Failure (MERIT-HF) JAMA 2000;283:1295-1302.
11. Ghio S. et al. Effects of nebivolol in elderly heart failure patients with or without systolic left ventricular dysfunction: results of the SENIORS echocardiographic substudy EurHeart J 2006;27:562–568.
12. Swedberg K., et al. Ivabradine and outcomes in chronic heart failure (SHIFT): a randomised placebo-controlled study. Lancet 2010;376:875-885.
13. McMurray J., et al. Angiotensin–Neprilysin Inhibition versus Enalapril in Heart Failure. Engl J Med 2014; 371:993-1004.
14. Fonarow G. et al. Lancet 2008; August 31, DOI:10.1016/S0140-6736(08)61241-6.